
近日,北京理工大学前沿交叉科学研究院黄渊余课题组在新型可电离脂质的核酸递送载体以及降血脂siRNA药物研究方面取得重要研究进展。该成果以《Thermostable ionizable lipid-like nanoparticle (iLAND) for RNAi treatment of hyperlipidemia》为题发表于《Science Advances》(IF= 14.136)。该论文第一作者为北京理工大学生命学院/前沿交叉科学研究院博士研究生胡泊,通讯作者为黄渊余教授。前沿交叉院李博副研究员、梁兴杰兼职教授等亦参与了研究和讨论。
核酸生物医药,包括小干扰核酸(siRNA)、信使核酸(mRNA)、反义核酸(ASO)、基因编辑系统(CRISPR/Cas)等,是人类未来制药技术的代表性方向。基于mRNA的新型核酸疫苗(Moderna的mRNA-1273、BioNTech/辉瑞的BNT162b2)在全球新冠疫情防控中发挥了重要作用。同时,与传统小分子药物、抗体蛋白药物相比,siRNA药物具有靶点范围更广、药效时间更长、开发周期更短、成功率更高等突出优势。但缺乏安全高效、生产可控、自主知识产权的体内递送系统,是上述核酸药物或疫苗研发所面临的关键“卡脖子”难题。可电离脂质纳米颗粒(ionizable lipid nanoparticle, iLNP)是最具前景、应用最成熟、竞争最激烈的递送载体类型。
近几年,黄渊余团队构建了一个新型可电离脂质分子库,从中选择了不同结构的亲水头和不同基团的疏水尾,组合并合成了其中4种可电离脂质作为研究代表。研究人员利用正交试验设计(DOE)将含有可电离脂质、磷脂、胆固醇、聚乙二醇脂质的候选配方从1024个降至64个,表征其理化性质,并在细胞水平进行了活性筛选。结果显示,这些候选配方均实现了siRNA的高效负载,且大部分实现了对靶标mRNA的高效抑制。最后,研究人员将最优选的脂质纳米体系命名为iLAND(ionizable lipid assisted nucleic acid delivery system/可电离脂质辅助的核酸递送系统,也称为intelligent LANDing technology/智能“着陆”技术)。
接着,研究人员用iLAND负载靶向ApoB基因的siRNA。在小鼠体内单次注射0.01-3 mg/kg该制剂后,检测到iLAND介导的半数有效剂量(ED50)低至0.18 mg/kg,单次给药后4周仍可实现约50%的基因抑制。此外,所有接受测试的动物均耐受良好,血清生化以及病理学分析结果也证明iLAND具有良好的体内安全性。

图1 siRNA@iLAND的递送效率以及安全性评估
进一步,研究人员分别以饲料诱导的高脂血小鼠、db/db转基因小鼠以及人源化载脂蛋白C3(ApoC3)转基因小鼠作为疾病动物模型,模拟了人类由不健康饮食引起的高脂血症以及单基因表达异常诱发的高脂血症。实验结果证明,在经过重复给药后,0.25mg/kg的siRNA制剂在三种模型中均将疾病动物的血脂水平调整至与正常动物相当的水平。此外,0.5mg/kg的siRNA在db/db小鼠体内实现了97%的靶标mRNA表达下调。在转基因动物中,血脂水平在停药后4周后回复到治疗前。总的来说,由iLAND递送的siRNA极为高效地抑制了靶标mRNA的表达,进而带来了十分积极的降血脂治疗效果。
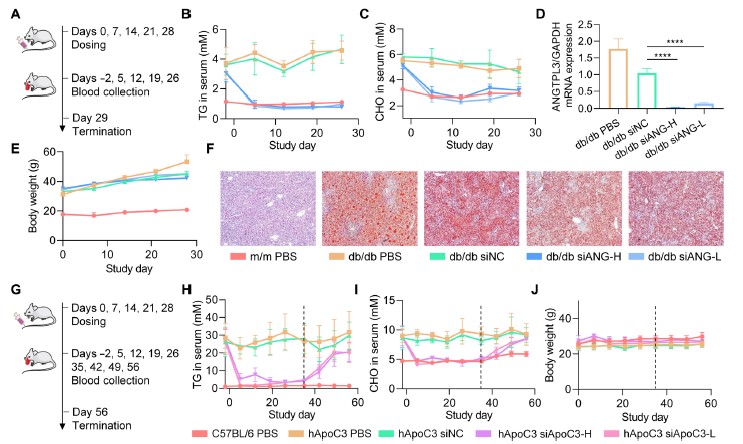
图2 在小鼠疾病模型上进行的药效试验。
iLAND体系除了具备递送效率高、安全性好、疗效佳的优点外,还显示了良好的化学结构稳定性和制剂稳定性,具备优良的药物开发潜力。进一步,iLAND还拥有理想的体内递送mRNA的效果(数据未发表)。上述研究成果已提交PCT专利申请。
论文链接: https://www.science.org/doi/10.1126/sciadv.abm1418
附作者简介:
黄渊余,北京理工大学教授、课题组长、博士生导师;国家级青年人才获得者、北京市科技新星。研究兴趣主要围绕核酸技术与药物/疫苗展开。以通讯/第一作者在Sci Adv、Signal Transduct Target Ther、Nano Lett等发表论文50余篇,IF>10论文20余篇;共发表论文约80篇,撰写10余部专著章节,申请14件专利。曾获得中美纳米医学与纳米生物技术学会“未来之星”奖(2019)等荣誉;是中国生物物理学会纳米生物学分会秘书长,另多个学会理事或委员;是Exploration副主编(Wiley出版)、Chinese Chemical Letters、生物化学与生物物理进展等多个期刊(青年)编委。
教师主页: https://www.x-mol.com/groups/Yuanyu_Huang-BIT
以上内容由大学时代综合整理自互联网,实际情况请以官方资料为准。