近日,综合性权威杂志《Proceedings of the National Academy of Sciences of the United States of America》和物理化学专业期刊《Physical Chemistry Chemical Physics》上发表了上海交通大学生命科学技术学院、微生物代谢国家重点实验室教授赵一雷研究团队在硫修饰DNA研究的最新进展, 分别题为“Origin of iodine preferential attack at sulfur in phosphorothioate and subsequent P-O or P-S bond dissociation”(PNAS, 2022, 119(17):e2119032119)、“Molecular recognition between bacterial phosphorothioate DNA and sulfur-binding domain (SBD): competition between the water cage and chalcogen-hydrophobic packet”(PCCP, 2022, 24: 9176 - 9187)两篇关于硫修饰DNA中“硫-碘”强卤键和“硫-氮Pro”弱硫键的研究成果。PNAS工作阐明了磷硫酰化修饰位点与碘分子之间超强“硫-碘”卤键引发了一系列化学反应, 导致在硫修饰位点发生DNA骨架剪切或硫氧转化,揭示了在碘切法深度测序中硫修饰位点高选择性剪切的分子机制。PCCP工作阐明了硫结合蛋白SBD利用脯氨酸的非氢键骨架氮的特殊电子结构高效区分正常DNA和硫修饰DNA,提出了“硫键-疏水”协同推拉分子识别机制。
PNAS论文中上海交大生命科学技术学院博士黄强、博士生李甲乙和美国加州大学洛杉矶分校Gina Young Lee博士为共同第一作者,生命科学技术学院教授赵一雷和中国科学院外籍院士、教授Houk为共同通讯作者;PCCP论文中博士生李甲乙为第一作者,共同通讯作者博士刘光负责PT-DNA蛋白结合实验验证。上海交通大学生命科学技术学院为两篇学术论文的第一署名单位/通讯单位。
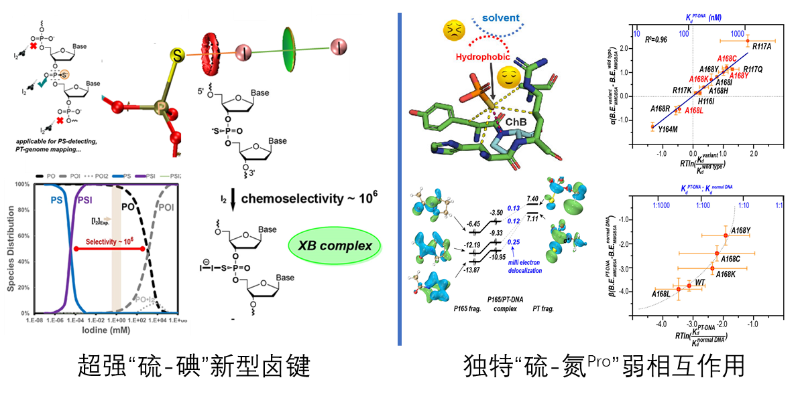
碘切反应对DNA磷硫酰化修饰位点高度敏感,广泛用于硫修饰细菌的DNA凝胶电泳检测、深度测序和单分子测序。尽管其广泛应用潜力,但切割机制并不清晰,一直以来并不清楚是否每个磷硫酰化修饰位点都被准确而且完全地切割。研究团队从碘切实验现象出发,利用高阶电子密度泛函理论计算揭示了碘分子通过超强的“硫-碘”卤键与硫修饰DNA中硫原子化学选择性结合,转化为磷酸三酯类似物中间体而引发修饰位点的磷-氧键水解断裂,因而硫修饰DNA的碘切割效率受限于硫氧转化的旁路竞争。该成果为进一步研发硫修饰DNA的碘法精准深度测序提供了理论基础。
在生物体内硫修饰DNA通过与蛋白质相互作用实现诸如表观遗传调控、限制性修饰等特殊的生理功能。虽然在反义RNA药物开放中广泛使用硫磷化修饰以增强对血浆、细胞表面和细胞内蛋白质的结合亲和力,但生理性DNA硫修饰的分子识别机制与已知的人工设计核酸药物迥然不同。基于限制性内切酶ScoMcrA 的共晶体结构,作者利用热力学积分计算纠正了广为流传的“硫疏水性”驱动,阐明了正常DNA的强水合作用和硫修饰DNA的弱水合作用是PT-DNA进入蛋白疏水空穴的主要驱动力,并从中发现了独特的“硫-氮Pro”硫键弱相互作用,它只存在于天然的硫修饰DNA和SBD蛋白的复合物中,而不存在于任何已知的人工合成硫代磷酸核苷酸和药物靶标蛋白的复合物中。这种非共价相互作用是由P-S键的σ*反键轨道与脯氨酸残基的氮孤对之间的电子离域形成的,其特征为超近的 S---N 距离和线性 P-S---N 夹角。这项研究为基于SBD硫识别蛋白的、PT-DNA引导的基因编辑分子机器提供了理论基础。
该工作得到了国家重点研发计划、自然科学基金面上项目、教育部代谢与发育科学国际合作联合实验室的资助。
论文链接:
https://www.pnas.org/doi/full/10.1073/pnas.2119032119
https://doi.org/10.1039/D2CP00291D
以上内容由大学时代综合整理自互联网,实际情况请以官方资料为准。