电子式局限性电子式表达物质结构时有一定的局限性,例如O2(两个三中心π键);臭氧(三中心四电子π键);超氧化物(三电子π键);臭氧化物(三中心五电子π键);二氧化碳,一氧化二氮,叠氮根N3-(三中心四电子π键)等,都不能用电子式表示其结构
电子式局限性较大,只能表述一小部分物质的结构
而真正意义上的结构是不能用电子式表示的
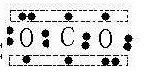
注意CO2属于不能用电子式解释的化合物(存在大π键),中学对于CO2结构的描述完全错误
因为实验证明,二氧化碳中C-O键键长介于一氧化碳(典型的三键)与羰基(双键)之间,这是电子式所不能解释的
对二氧化碳结构的正确描述:在CO2分子中,碳原子采用sp杂化轨道与氧原子成键
C原子的两个sp杂化轨道分别与两个O原子生成两个σ键
C原子上两个未参加杂化的p轨道与sp杂化轨道成直角,并且从侧面同氧原子的p轨道分别肩并肩地发生重叠,生成两个∏三中心四电子的离域键
因此,缩短了碳—氧原子间地距离,使CO2中碳氧键具有一定程度的叁键特征
CO2的正确结构:
以上内容由大学时代综合整理自互联网,实际情况请以官方资料为准。