新闻网讯(通讯员姜恺)5月23日,国际学术期刊Journal of Cell Biology(《细胞生物学杂志》)在线发表武汉大学医学研究院/口腔医学院、免疫与代谢前沿科学中心姜恺教授课题组在有丝分裂纺锤体组装研究领域的最新成果。该研究提出了微管分支成核的新模型,这是纺锤体组装研究领域的一项重要进展。
论文题为“Reconstitution and mechanistic dissection of the human microtubule branching machinery”(《微管分支成核的体外重组和机制研究》)。医学研究院博士研究生张雅倩为论文第一作者,姜恺为通讯作者,武汉大学为第一署名单位。
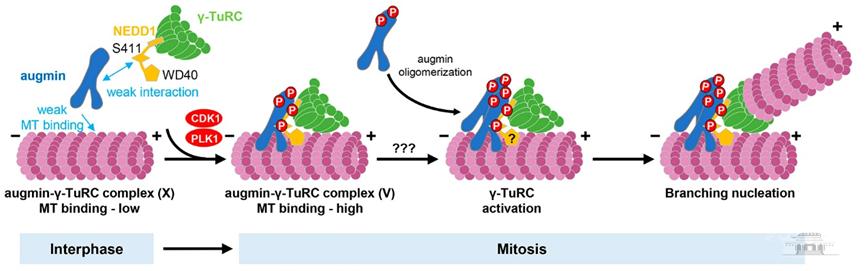
有丝分裂纺锤体的主要组成成分为微管及其结合蛋白。纺锤体动态性组装的精确调控对于遗传物质的正确分配至关重要,其紊乱将导致发育异常和肿瘤等疾病。有丝分裂纺锤体组装过程中新生微管主要成核于中心体、染色体动粒以及微管自身。这三类成核方式均依赖于成核因子γ-TuRC与特定招募因子的精准时空协作。其中最后一种依赖微管自身的成核方式也称为微管分支成核,需要招募因子augmin复合物的参与。然而这两个多亚基复合物在微管分支成核过程中协同发挥作用的分子机制仍未知。
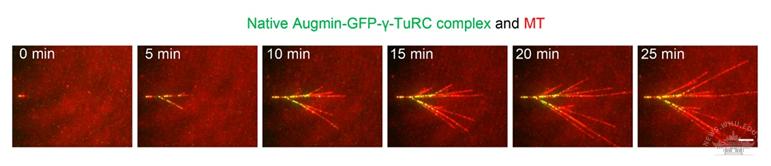
利用基于CRISPR/Cas9技术的荧光和纯化标签敲入细胞系以及课题组建立的哺乳动物细胞多基因表达体系,该研究首次纯化得到内源性和外源性重组的20亚基蛋白复合物augmin-γ-TuRC。通过体外微管重组实验证实该蛋白复合物足以在体外重现细胞内观察到的微管分支成核现象。成功实现对augmin与γ-TuRC在整个分支成核过程中的单分子荧光分析,进而揭示augmin寡聚化可激活成核因子γ-TuRC的分子机制。验证和揭示了CDK1与PLK1激酶磷酸化在分支成核中的具体调节机制,并深入解析了NEDD1作为augmin和γ-TuRC之间的桥梁分子,在分支成核中的关键作用。基于以上发现,作者提出了微管分支成核的新模型。此外,这项工作中建立的哺乳动物细胞多基因表达体系可广泛应用于其他多亚基生物功能大分子的结构和生化特性研究。

该研究得到国家自然科学基金面上项目和中央高校基本科研业务费专项资金资助。
论文链接:
https://rupress.org/jcb/article/221/7/e202109053/213234
以上内容由大学时代综合整理自互联网,实际情况请以官方资料为准。