图 人类卵母细胞纺锤体组装机制
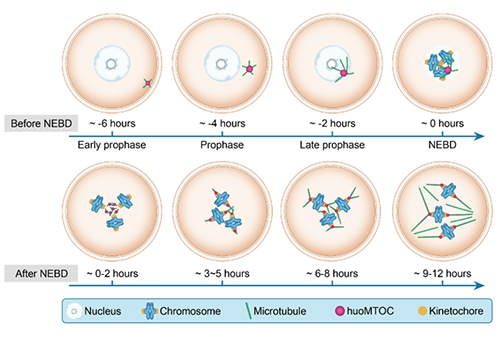
在国家自然科学基金项目(批准号:81725006、82101737、82171643和81971450)等资助下,复旦大学王磊、桑庆和孙晓溪合作团队在人类卵母细胞纺锤体组装机制方面取得进展,研究成果以“人类卵母细胞无中心体纺锤体组装机制(The mechanism of acentrosomal spindle assembly in human oocytes)”为题,在《科学》(Science)杂志上发表。文章链接:https://www.science.org/doi/10.1126/science.abq7361。纺锤体的正确组装是哺乳动物有丝分裂和减数分裂顺利进行的关键事件,只有纺锤体的精确组装才能保证染色体的正确分离及后续细胞和胚胎的正常分裂及发育。人类体细胞的纺锤体组装由中心体介导,而卵母细胞中并不存在中心体,其纺锤体如何组装 尚不清楚。 研究团队发现人类卵母细胞核膜破裂后形成的纺锤体微管主要聚集于染色体的动粒位置,且在第一次减数分裂中期(MI期)有四个蛋白(CCP110、CKAP5、DISC1 和 TACC3)同时定位于动粒和微管,这与它们在有丝分裂过程中的定位截然不同;随后发现在生发泡期(GV期)核膜附近这四个蛋白组成了一种此前未被发现的特殊结构,同时在该结构周围观察到新生微管聚集,而在鼠、猪卵母细胞中并未观察到该结构。由于该结构在人类卵母细胞中负责聚合微管,因此将其命名为人类卵母细胞微管组织中心(huoMTOC)。huoMTOC形成于卵母细胞皮质区,并于核膜破裂(NEBD)前迁移到核膜附近;随着NEBD的发生,huoMTOC开始碎裂并逐渐定位于动粒,同时在动粒附近起始纺锤体微管的聚集和生长。当huoMTOC结构被破坏时,人类卵母细胞中的纺锤体微管则会聚合受阻,最终导致无法形成纺锤体;为了进一步确定huoMTOC是否具有临床意义,研究人员在卵母细胞成熟障碍患者中进行突变筛查发现两位患者携带TACC3的复合杂合致病突变,而且患者GV期卵母细胞的huoMTOC结构被完全破坏,同时在MI期卵母细胞中没有纺锤体形成(图)。以上内容由大学时代综合整理自互联网,实际情况请以官方资料为准。