近日,上海交通大学夏小霞课题组应邀在《Nature Chemical Biology》发表题为 “Synthetic protein condensates for cellular and metabolic engineering”的综述论文,系统阐述了人工蛋白质凝聚体(无膜细胞器)的设计原理、构建方法(图1),以及在细胞生理代谢调控方面的前沿应用。生命科学技术学院钱志刚副研究员为第一作者,黄盛晨博士为第二作者,夏小霞教授为通讯作者。
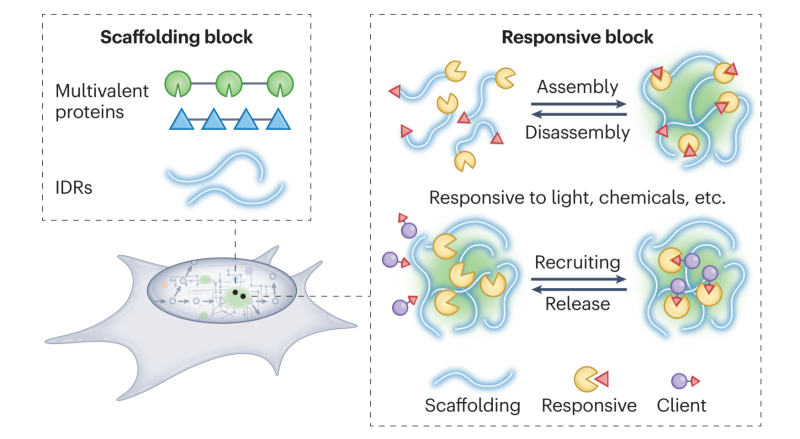
图1 无膜细胞器驱动的细胞代谢调控
无膜细胞器是近年来在真核生物中发现的一类亚细胞区室结构,主要通过细胞内蛋白质或核酸等大分子经历液-液相分离聚集形成。与传统脂膜包被的有膜细胞器相比,无膜细胞器具有更好的物质交换和响应生理刺激的动态特性,在细胞的生理、病理过程中扮演着举足轻重的作用。这类细胞器在原核生物中是否存在以及拥有什么功能,同样吸引着越来越多生物学家的关注和探索。
天然无膜细胞器的结构功能研究,启发了科学家有目的地改造甚至从头设计无膜细胞器,赋予工程化细胞更好的或以往没有的新功能。夏小霞课题组前期利用类蛛丝蛋白、类节肢弹性蛋白等人工结构蛋白质的液-液相分离特性,率先在原核生物大肠杆菌中构建了人工无膜细胞区室,进而建立了荧光蛋白、酶等功能蛋白质融合共定位至区室的功能化平台,初步展现了原核细胞内生化反应时空调控的可行性和优越性(Nature Chemical Biology, 2020, 16:1143-1148)。
基于以上成果,该课题组结合国内外同行的相关研究,在综述论文中系统提出人工无膜细胞器驱动的细胞代谢调控研究思路,通过模块化设计和精准组装,构建具有特定生物学功能的人工无膜细胞器体系。论文首先阐述了天然蛋白质经历液-液相分离形成无膜细胞器的分子基础,依据蛋白凝聚体的形成、功能及响应三个维度,对其蛋白组分进行模块化拆解及工作原理解析,进而指导人工设计、组装及适配,创建响应生理刺激按需形成或消解的人工无膜细胞器,实现在特定的时间及胞内特定区域发挥预设的生物学功能,克服以往由于高度分散造成的蛋白质难以“限域”发挥作用的不足。最后,作者探讨了人工无膜细胞器在细胞重编程过程中面临的机遇和挑战,并提出了可能的应对策略。
该研究获得科技部国家重点研发计划(2020YFA0907702)和国家自然科学基金(32071414)等项目的资助。
论文链接:https://doi.org/10.1038/s41589-022-01203-3
以上内容由大学时代综合整理自互联网,实际情况请以官方资料为准。