新闻网讯(通讯员药学院)6月1日,Nature(《自然》)在线发表我校药学院刘天罡教授团队联合日本东京大学、德国波恩大学团队,在天然产物生物合成领域的最新研究成果。

论文题为“Discovery of non-squalene triterpenes”(《非角鲨烯来源三萜的发现》),颠覆了长期以来陆续揭示的“所有三萜化合物都是以角鲨烯为唯一起始单元合成”的固有认知,发现了多个三萜化合物都是由I型萜类合酶催化而来,一定程度上填补了这一庞大类群的天然产物合成机制多样性的认知空白,拓宽了新型三萜化合物深度挖掘和精准发现的空间。
东京大学博士后陶慧博士、波恩大学Lukas Lauterbach博士、武汉大学中南医院药学研究院卞光凯研究员、中南医院泌尿外科博士后陈蓉博士、波恩大学博士后侯安伟博士、东京大学Takahiro Mori博士为共同第一作者。东京大学IkuroAbe教授、波恩大学Jeroen S.Dickschat教授、武汉大学刘天罡教授为共同通讯作者。陶慧、卞光凯、陈蓉和侯安伟曾先后于武汉大学刘天罡课题组获得博士学位,其中两位前往日本和德国继续从事与这个项目系统相关的博士后研究,成功搭建起国际合作桥梁。该项研究得到国家重点研发计划合成生物学专项以及国家自然科学基金等项目资助。
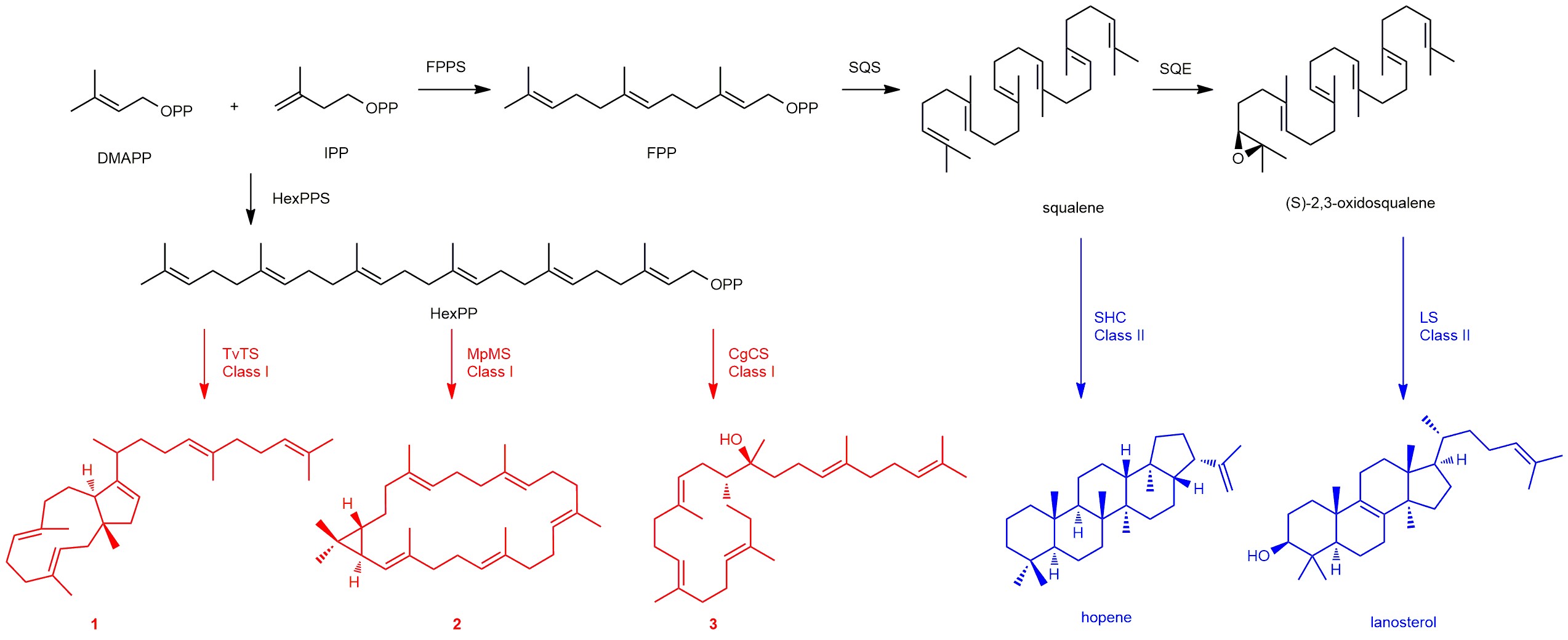
三萜化合物是具有广泛生物活性的一大类天然产物,已有两万多种被先后发现,成药四百多种,包括临床上广泛使用的众多重要的甾体激素类药物和人参皂苷等天然产物,在保障人类健康和提高生活质量方面发挥着不可替代的作用。由于两万多种该类产物已被发现,其合成机理的传统认知已经长期固化:三萜化合物始于角鲨烯合酶催化两分子法尼基焦磷酸形成角鲨烯,进一步氧化生成环氧角鲨烯,而后三萜合酶负责催化角鲨烯或环氧角鲨烯环化形成霍烯或羊毛甾醇,庞大的结构多样性则是由众多不同的修饰酶催化而成。

在利用高效酿酒酵母底盘挖掘萜类天然产物过程中,刘天罡团队首次发现丝状真菌来源的I型嵌合萜类合酶TvTS和MpMS的异戊烯基转移酶结构域能够催化异戊烯基焦磷酸(IPP)和烯丙基焦磷酸(DMAPP)缩合生成六聚异戊烯基焦磷酸(HexPP),随后萜类合酶结构域催化HexPP环化生成全新三萜骨架。随后的体内基因激活实验和体外酶促反应都证明合成三萜终产物确实是这类酶所为。Dickschat教授团队进一步通过体外同位素喂养实验解析上述三萜骨架talaropentaene的绝对构型和环化机理以及具有最大环系以及新颖环化机理的三萜骨架macrophomene的产物结构和环化机制。随后,Abe教授团队通过结构生物学手段分别解析了TvTS的萜类合酶结构域和MpMS的六聚体结构,并结合关键位点氨基酸的突变,阐明了TvTS和MpMS合成三萜骨架的催化机理。
这种非角鲨烯来源三萜骨架合成方式是否普遍存在?能否通过精准高效靶向挖掘这类萜类合酶,批量获得更多的新三萜骨架天然产物?通过AlphaFold2进行萜类合酶三维结构的批量预测,并结合预测结构与底物分子的对接,刘天罡团队高效地从基因库中筛选获得另外两个三萜合酶CgCS和PTTC074,它们能够成功合成新三萜骨架colleterpenol,夯实了I型嵌合萜类合酶催化HexPP环化生成三萜骨架的普遍性机理。
这是继今年四月在Nature Catalysis(《自然•催化》)杂志发表“丝状真菌萜类生物合成基因簇的高效挖掘”论文以来,刘天罡团队在该领域取得的又一系统性、完整性和突破性进展。该研究让我们更加深刻地领略了深度挖掘自然界中天然产物“暗物质”的巨大潜力和威力,这种海量的基因组宝藏位于一个庞大的“黑洞”中,对它创造性地批量挖掘是未来利用合成生物学技术撬动人类新资源,包括新药物等大健康产品的发现、改造、优化和利用的钥匙,也会引领天然产物的发现进入新的高度和深度,并以此丰富和改善我们的生活。
论文链接:https://www.nature.com/articles/s41586-022-04773-3
以上内容由大学时代综合整理自互联网,实际情况请以官方资料为准。