新闻网讯(通讯员彭伟)Cell Reports(《细胞报告》)杂志近日在线发表了武汉大学医学研究院/口腔医学院、免疫与代谢前沿科学中心张好建教授课题组在巨噬细胞炎症反应领域的最新成果。该研究揭示了表观遗传相关分子PTIP调控巨噬细胞NAD+代谢关键水解酶CD38的表达,影响巨噬细胞NAD+代谢与炎症反应的作用及分子机制。
论文题为“PTIP governs NAD+metabolism by regulating CD38 expression to drive macrophage inflammation”(《PTIP-CD38信号轴调控巨噬细胞NAD+代谢与炎症反应》),武汉大学医学研究院、免疫与代谢前沿科学中心博士生王启帆,胡瑾,韩国强为并列第一作者,张好建为通讯作者,武汉大学为第一署名单位。

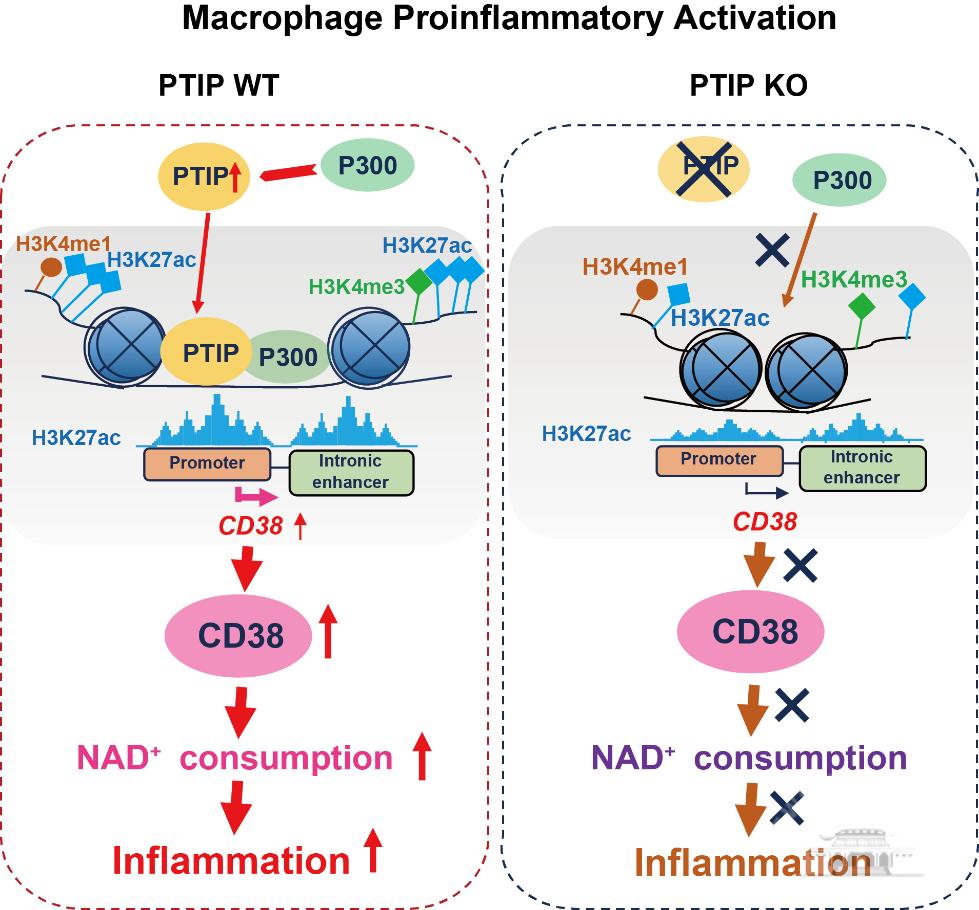
模式图:PTIP招募p300到CD38的顺式调节区域介导巨噬细胞NAD+代谢和炎症反应
NAD+参与线粒体电子传递等多种氧化还原反应,在能量代谢中作为辅酶发挥重要作用。同时,NAD+作为多种酶的底物,参与细胞信号传导、DNA损伤修复、表观遗传修饰等生物学过程。NAD+代谢也在代谢疾病、癌症、衰老和炎症等各种疾病的发生发展中起着关键作用。因此,解析NAD+代谢的调控机制是重要科学问题。
作为天然免疫细胞的主要成员之一,巨噬细胞能够快速识别病原体,启动炎症和免疫反应以抵抗感染,在血液生态、免疫调控与组织器官稳态中起重要作用。近来研究表明,巨噬细胞活化过程中发生了代谢重编程,以满足其能量和生物合成等需求。NAD+从头合成和补救途径都是巨噬细胞促炎活化所必需的,同时,巨噬细胞促炎活化也伴随着NAD+的快速消耗。跨膜蛋白CD38消耗NAD+,形成环ADP核糖(cADPR)、ADP核糖(ADPR)和NAM,被认为是巨噬细胞中主要的NAD+水解酶。然而,巨噬细胞活化过程中NAD+代谢的调控机制仍不清楚。
张好建课题组首先采用ChIP-seq和RNA-seq技术,解析了巨噬细胞活化过程中的组蛋白H3K4me1、H3K4me3、H3K27ac修饰与NAD+代谢相关基因表达水平的相关性;发现MLL3/4复合物亚基PTIP可能是调控炎症巨噬细胞中NAD+水解酶CD38表达的关键分子。课题组进一步构建了Ptip条件性敲除小鼠,开展了一系列体内、体外实验,证实了PTIP在调控巨噬细胞炎症反应和NAD+代谢功能具有重要作用。
PTIP缺失会损害人和小鼠来源的原代巨噬细胞的炎症反应,促进糖酵解向氧化磷酸化的代谢转换,并下调CD38的表达进而影响NAD+代谢。在生理功能上,巨噬细胞中PTIP的缺失明显降低了小鼠抗李斯特菌感染的能力,并能够改善DDS诱导的小鼠结肠炎症。在机制上,课题组发现了CD38内含子上存在的增强子元件;PTIP与乙酰转移酶p300结合,促进p300招募到该增强子区域并上调H3K27ac修饰水平,进而调控CD38的表达与NAD+代谢。
该研究揭示了PTIP在巨噬细胞炎症反应中的重要作用,阐明了PTIP协同p300调控CD38增强子活性,影响NAD+代谢与巨噬细胞活化的分子机制,对深入理解生理病理下巨噬细胞活化以及表观与代谢互作的调控网络具有重要意义。
据悉,该研究获得了化学与分子科学学院冯钰锜教授课题组与中南医院候晋轩医生的大力支持,得到了国家自然科学基金优秀青年和面上项目、湖北省自然科学基金杰出青年和创新群体等项目的资助以及武汉大学医学腾飞计划(基础医学)的支持。
论文链接:
https://doi.org/10.1016/j.celrep.2022.110603
以上内容由大学时代综合整理自互联网,实际情况请以官方资料为准。